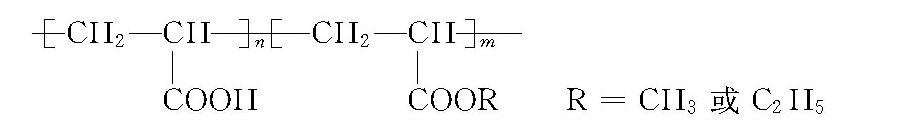磷酸钙在水中有以下溶解及电离关系:
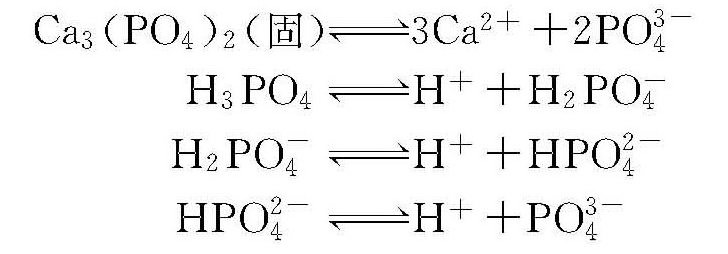
磷酸钙的溶度积常数KS=[Ca2+]3[PO3-4]2=10-28~10-33
报道的KS数据相差很大,可能因磷酸钙容易过饱和,难测准。一般多采用KS=5×10-30。
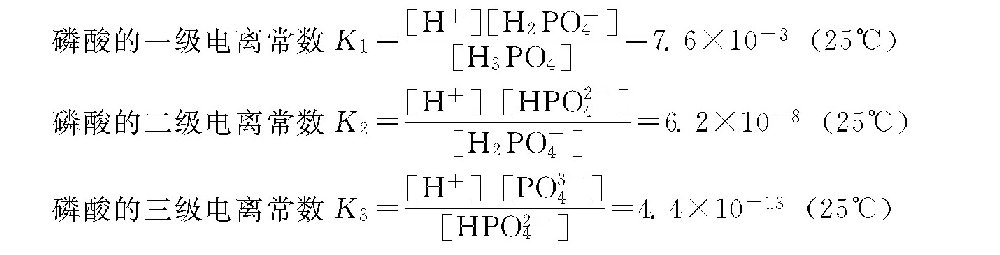
当温度一定时,K1、K2、K3及KS均为固定值。当H+浓度(即pH值)变化时,电离平衡发生变化。H+增加(即pH值降低)时,电离平衡式向左进行;PO3-
4减少,溶解平衡式向右进行。即Ca3(PO4)2在水中处于不饱和状态,固体Ca3(PO4)2会继续溶解。反之,当H+减少(即pH值升高)时,电离平衡式向右进行;PO3-
4增加,溶解平衡式向左进行。则Ca3(PO4)2在水中呈过饱和状态,倾向于沉积,即可能结Ca3(PO4)2水垢。pHP为Ca3(PO4)2的饱和pH值,在此pH值下Ca3(PO4)2处于饱和状态,既不溶解也不沉积。pHP由Ca3(PO4)2的溶解及电离平衡常数推导计算。
令[∑]=[H3PO4]+[H2PO-4]+[HPO2-4]+[PO3-4]
经推导后得出下式:
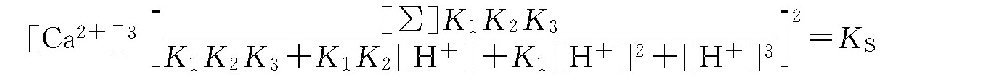
两边取对数,并经整理得到下面的计算式。
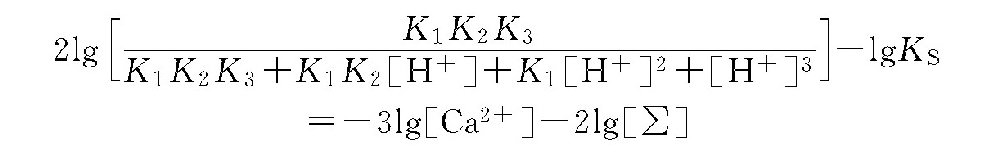
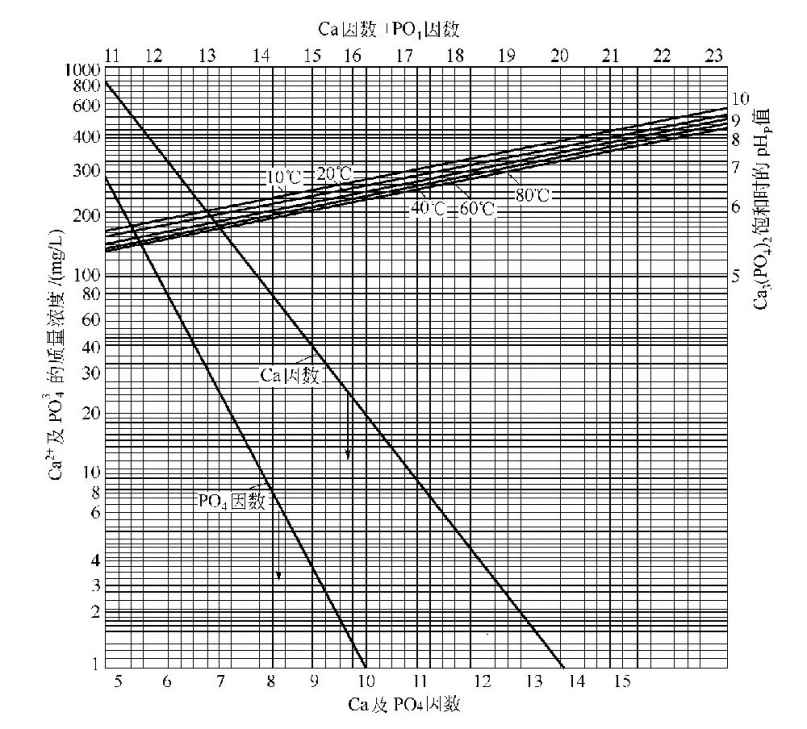
该式的左侧二项统称为pH-温度因数(FpH-t),因K1、K2、K3及KS均随温度而变,[H+]决定pH值。式中右侧二项各为钙因数(FCa)和磷酸盐因数(FPO4)。即FCa=-3lg[Ca2+],FPO4=-2lg[∑]。当水中磷酸钙达到饱和时,水的pH值应为饱和pH值,即pHP。此时FCa+FPO4=FpH-t。通常将这三种因数的数据列成表格,以方便计算。
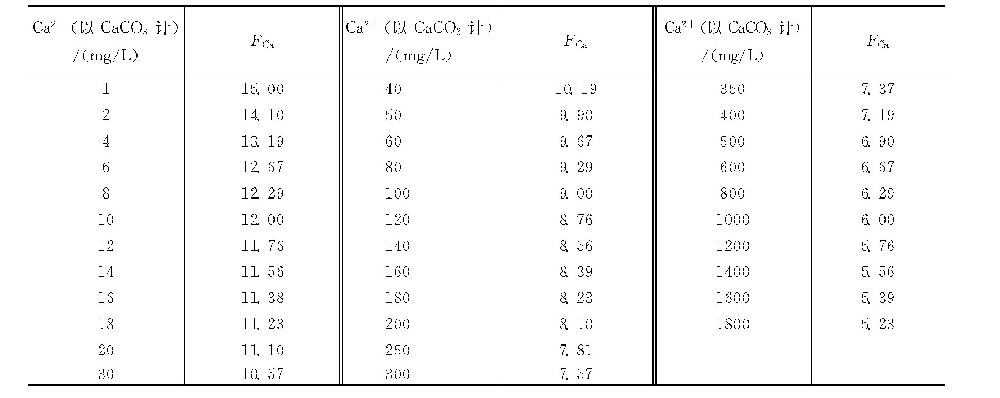
钙因数(FCa)可根据水中钙离子含量(mg/L,以CaCO3计)由钙因数表查出,也可按下式计算。
FCa=15.00-3lg(钙离子)
式中 钙离子———水中钙离子质量浓度,mg/L(以CaCO3计)。
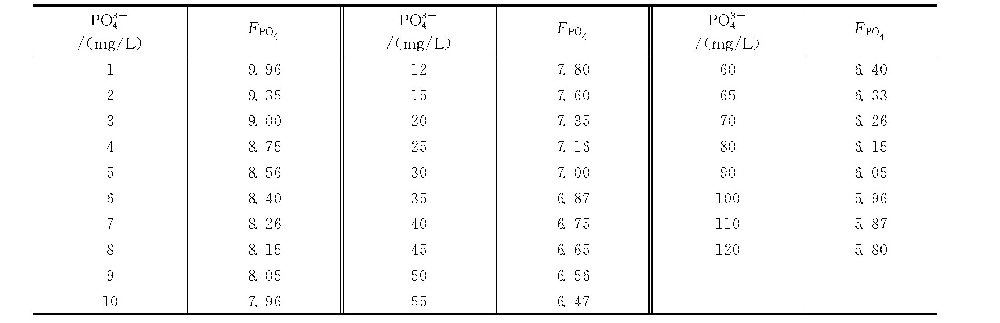
磷酸盐因数(FPO4)可根据水中总正磷酸盐含量(mg/L,以PO3-4计)由磷酸盐因数表查出,也可按下式计算。
FPO4=9.955-2lg(正磷)
式中 正磷———总正磷酸盐含量,mg/L(以PO3-4计)。
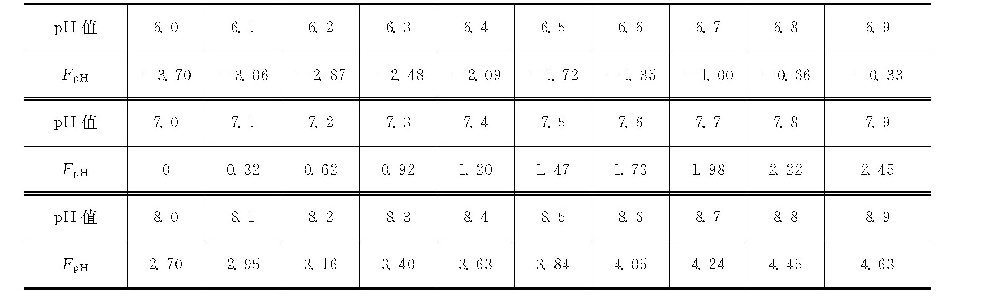
FpH-t=FCa+FPO4,根据FCa+FPO4及水的温度由pH值-温度因数表查得的pH值即为pHP值。
钙因数表
磷酸盐因数表
pH值-温度(FpH-t)因数表[7]
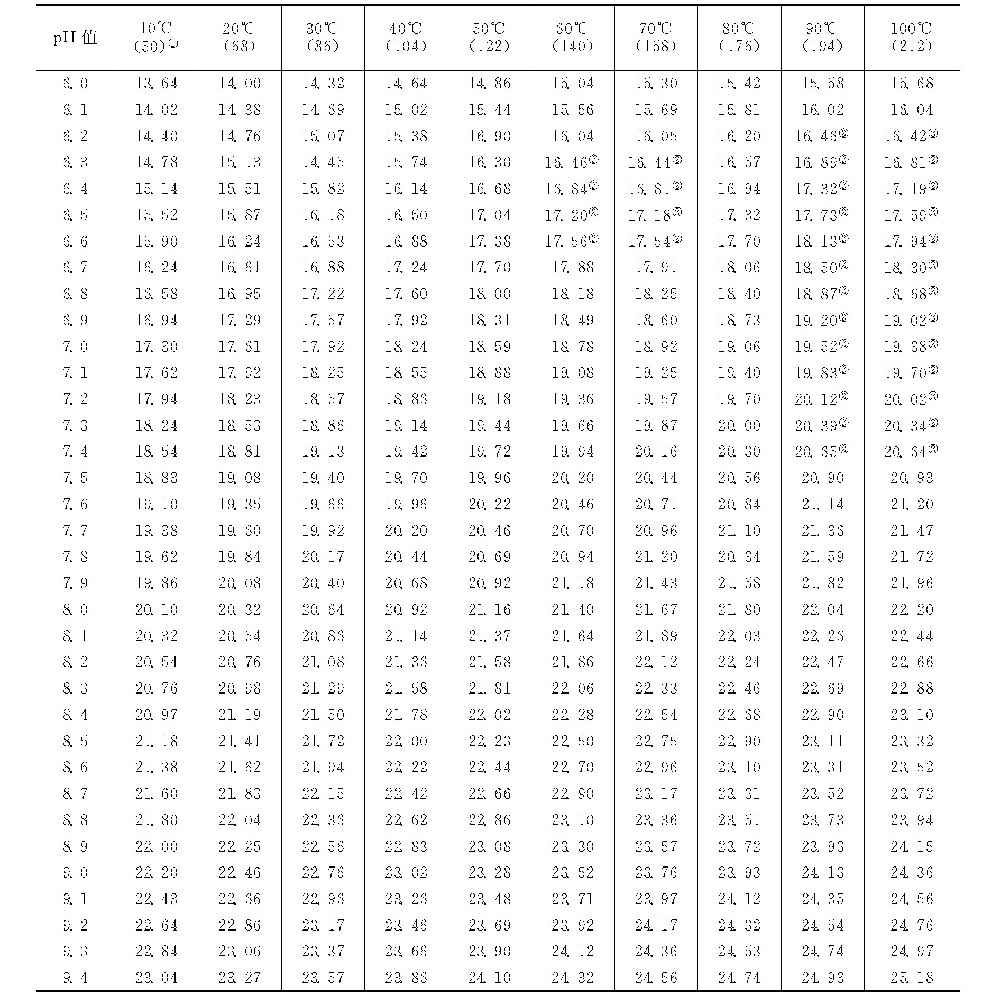
续表
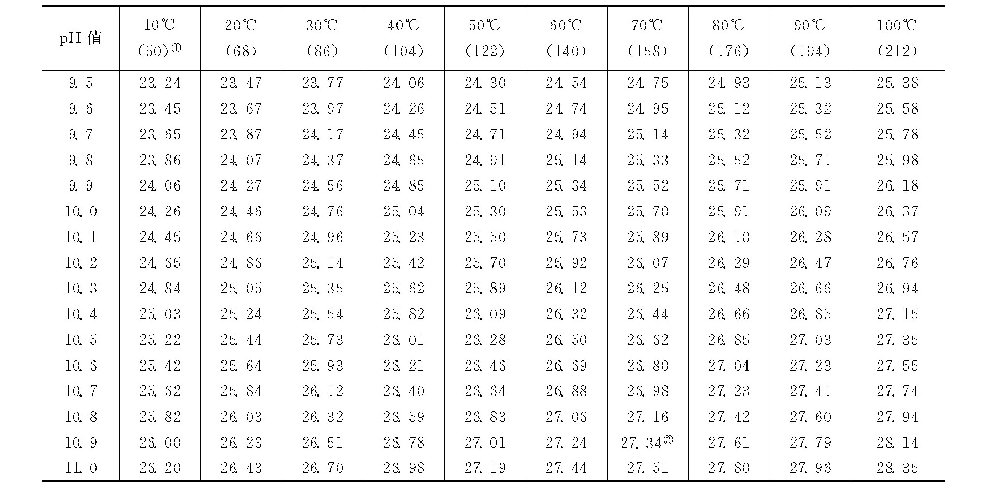
①括号内数字为华氏温度,°F。
②原资料来自美国Nalco公司资料,原文数据有些异常,也许有误差。
③原文为27.14。
计算例:如循环水中的钙离子含量为64mg/L(以CaCO3计为160mg/L),磷酸盐以PO3-4计为5mg/L,温度为40℃,则从钙因数表查得钙因数FCa=8.39,从磷酸盐因数表查得磷酸盐因数FPO4=8.56。则FpH-t=FCa+FPO4=16.95。查pH值-温度因数表,在40℃栏下,FpH-t为16.95时,pH值为6.62,即pHP为6.62。
还有另一种查表法计算FpH-t,即令FpH-t=FpH+Ft+17.5,分别从指数表或公式中查得或计算得FpH及Ft。这种查表法不如前法精确,但其优点是FpH和Ft可以分别计算,便于输入计算机计算。
温度指数(Ft)表

Ft回归计算式为:
10≤t<50℃时,Ft=0.031t-0.031
FpH回归计算式为:
pH值≤6.1时,FpH=3.8pH-26.44
6.1<pH值≤6.6时,FpH=3.72pH-25.90
6.6<pH值≤6.9时,FpH=3.466pH-24.23
6.9<pH值≤7.3时,FpH=3.05pH-21.34
7.3<pH值<7.7时,FpH=2.65pH-18.41
7.7≤pH值<8.1时,FpH=2.35pH-16.11
8.1≤pH值<8.5时,FpH=2.15pH-14.44
8.5≤pH值<8.9时,FpH=2.075pH-13.80
pH值≥8.9时,FpH=1.9pH-12.28
pH指数(FpH)表