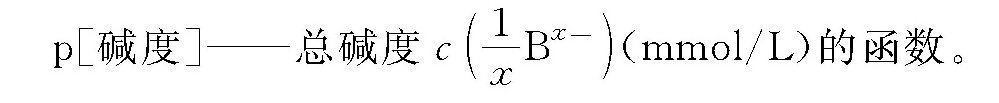碳酸钙饱和pH值是根据碳酸钙的溶解平衡和碳酸平衡状态确定的。碳酸钙在水中溶解时:
![]() 水中各级碳酸平衡反应式为:
水中各级碳酸平衡反应式为:
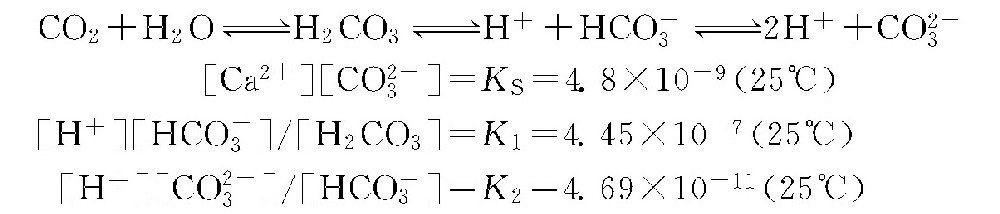
式中 KS———碳酸钙的溶解平衡常数或称碳酸钙的溶度积;
K1、K2———碳酸盐的一、二级电离常数。
碳酸平衡及碳酸钙溶解平衡反应可综合为下式:
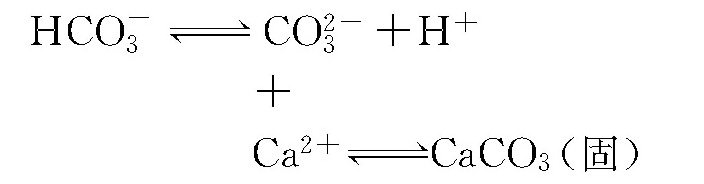
当达到饱和pH值时:
两边取p值(-lg值),则
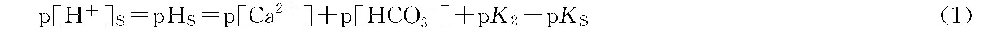
式中的[H+]、[Ca2+]与[HCO-3]均表示离子活度,[Ca2+]与[HCO-3]需根据分析值进行换算。
离子活度=分析值(mol/L)×αj=分析值(mg/L,以CaCO3计)×αj/(50×103×Zj)
式中 αj———活度系数;
Zj———电荷数;

故[Ca2+]=Ca(分析值,mg/L,以CaCO3计)×αCa/(50×103×2)
按碱度定义,
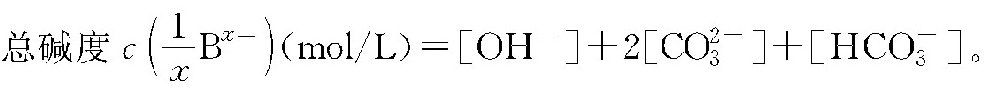 在循环水的条件下,一般pH值<9,OH-及CO2-3可忽略不计,故可认为总碱度M≈[HCO-3]。从而[HCO-3]=M(分析值,mg/L,以CaCO3计)×αHCO-3/(50×103×1)
在循环水的条件下,一般pH值<9,OH-及CO2-3可忽略不计,故可认为总碱度M≈[HCO-3]。从而[HCO-3]=M(分析值,mg/L,以CaCO3计)×αHCO-3/(50×103×1)
则(1)式可改为:
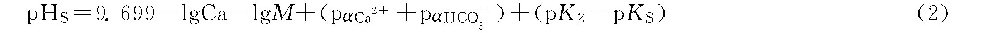
Ca2+和HCO-3的活度系数αCa2+及αHCO-
3由水的离子强度决定,为总溶解固体量(TDS,mg/L)的函数。令A=(pαCa2++pαHCΟ-3),为总溶解固体系数,可按下式计算:
A=2.5TDS1/2/(200+5.3TDS1/2+0.0275TDS)当TDS<3200mg/L,可简化为以下经验式:
A=0.1×lgTDS-0.1
令B=pK2-pKS,K2、KS均随温度而变化,故B为温度系数,可按以下回归式计算:
T<20℃时
B=2.596-0.0256T
20℃≤T<30℃时
B=2.512-0.0212T
30℃≤T<54℃时
B=2.368-0.0164T
54℃≤T<66℃时
B=2.242-0.014T
66℃≤T≤76℃时
B=2.042-0.011T
为此碳酸钙饱和pH值可按以下推荐公式计算。
pHS=9.699+A+B-C-D
或pHS=9.70+A+B-C-D
式中 A———总溶解固体系数;
B———温度系数;
C———钙硬系数,等于lgCa;
D———碱度系数,等于lg M。
因此,pHS可根据循环冷却水的总溶解固体量、水温(或典型换热器的壁温)、钙离子含量及碳酸氢根碱度(或近似用总碱度)计算。
国外另一个计算公式的计算结果也与上式相近,即:
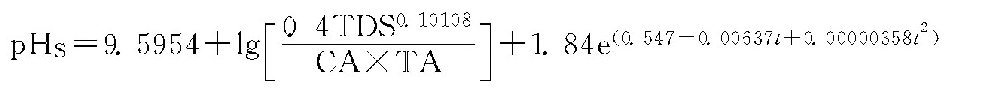
式中 TDS———总溶解固体量,mg/L;
CA———钙硬,以钙离子计,mg/L;
TA———碳酸盐碱度,以CaCO3计,mg/L;
t———温度,(=1.8×℃+32);
e———自然对数底数,约为2.718。