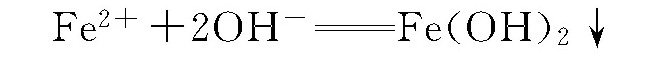天然水中最易成垢的化合物是碳酸盐,而碳酸盐在水中是极不稳定的。
1936年,朗格利尔(Langlier)根据水中碳酸的平衡关系,提出了饱和pH值和饱和指数的概念,以判断CaCO3水垢在水中是否会析出,并据此提出用加酸或加碱等办法来控制水垢的析出。所谓饱和pH值,即是碳酸钙在水中呈饱和状态时的pH值(pHS)。这时水中的碳酸氢钙不分解成CaCO3,碳酸钙也不会继续溶解。朗格利尔推导出计算饱和pH值(pHS)的公式,pHS可由水的硬度、总溶解固体量、碱度和水温计算得出,并以水的实际pH值与pHS值的差值来判断水垢的析出,此差值朗格利尔称它为饱和指数,以IS表示之。
他提出当IS>0时,水中的碳酸钙(CaCO3)必定处于过饱和状态,就有可能析出沉淀,这种水属结垢型水;当IS<0时,此时水中碳酸钙(CaCO3)必定处于不饱和状态,则原来附在传热面上的CaCO3垢层会被溶解掉,使金属表面裸露在水中而受到腐蚀,故而他把这种水称作腐蚀型水;当IS=0时,CaCO3既不析出,原有CaCO3垢层也不会被溶解掉,这种水属于稳定型,即不腐蚀也不结垢。如以式表示,则可写成: