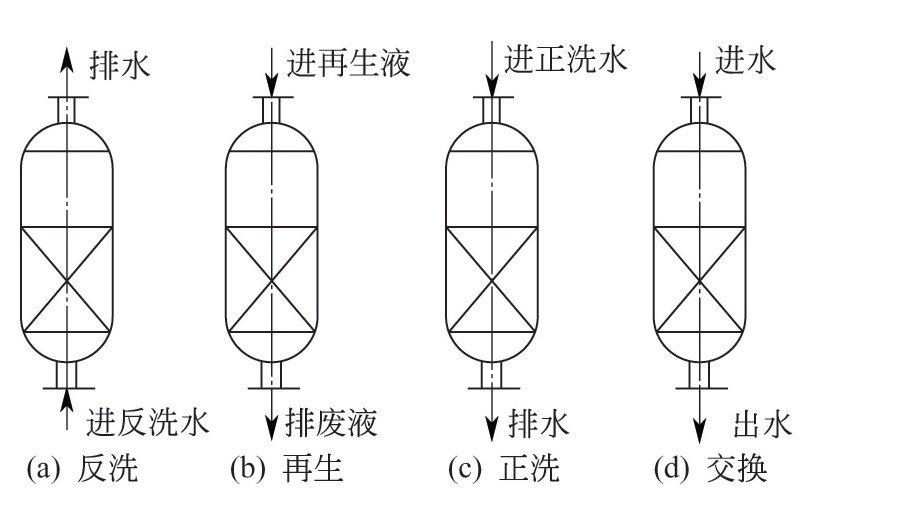
(1)水中溶解盐类浓度很高时,将使水的导电性增大,容易发生电化学作用,增大腐蚀电流使腐蚀增加。
(2)影响Fe(OH)2的胶体状沉淀物的稳定度,使保护膜质量变差,增大腐蚀。
(3)可使氧的溶解度下降,阴极过程减弱,腐蚀速度变小。
上面综合作用的结果,一般来说是使腐蚀增加。
关于水中不同离子与腐蚀的关系,一般有以下原则性认识:
(1)水中Cl-、SO2-4等离子的含量高时,会增加水的腐蚀性。Cl-不仅对不锈钢容易造成应力腐蚀,而且还容易破坏金属上的氧化膜,因此,Cl-也是使碳钢产生点蚀的主要原因。
(2)水中的PO3-4、CrO2-4、WO2-4等离子能钝化钢铁或生成难溶沉淀物覆盖金属表面,起到抑制腐蚀的作用。
(3)Ca2+、Zn2+、Fe2+等离子能与阴极产物OH-生成难溶的沉淀沉积于金属表面,起到防腐蚀作用。而Cu2+、Fe3+等具有氧化性的阳离子,由于能促进阴极去极化作用,因而是有害的。