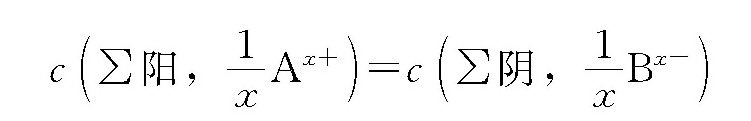碳酸是二元弱酸,可以进行分级电离,各级的平衡反应如下:
从式中可知,水中碳酸为以下三种形式:H2CO3、HCO-3及CO2-3。如果水中碳酸物的总量为C,则:
在一定温度下,当C值固定并达到电离平衡时,三种形式的碳酸量呈一定固定的比例。此比例将决定于氢离子的浓度。当H+增加时,pH值降低,反应向左进行,游离的H2CO3(或CO2)增多;当H+减少时,pH值升高,反应向右进行,则HCO-3、CO2-3依次增多。如果把这三种形式碳酸在总量中所占的比例分别以α0、α1、α2表示,则:
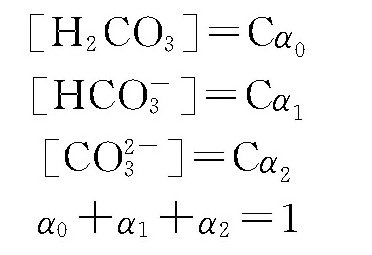
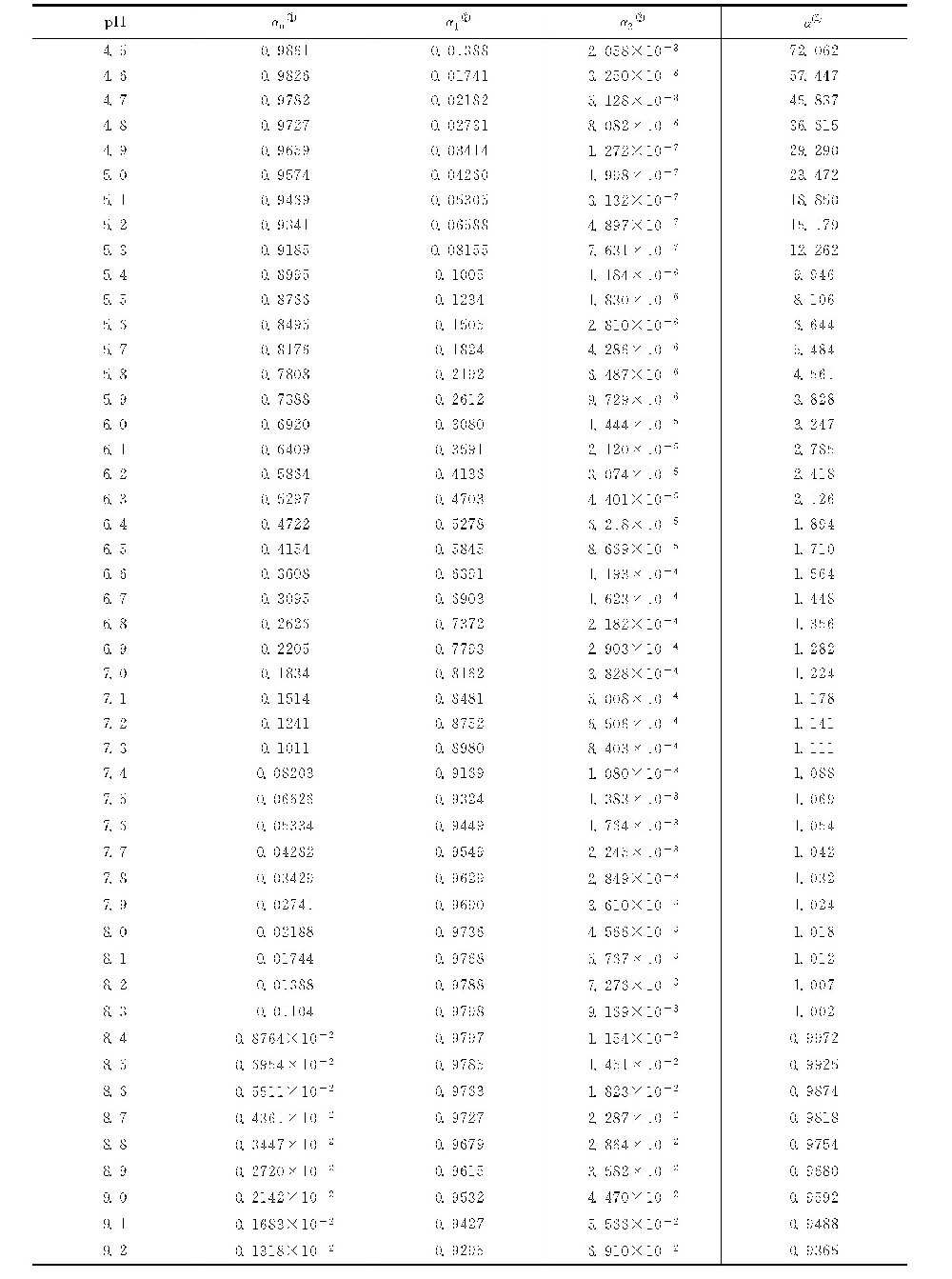
经计算,在25℃时,上述三种碳酸的比例与水中-lg[H+](即pH值)的关系如下表及图1-0-6所示:

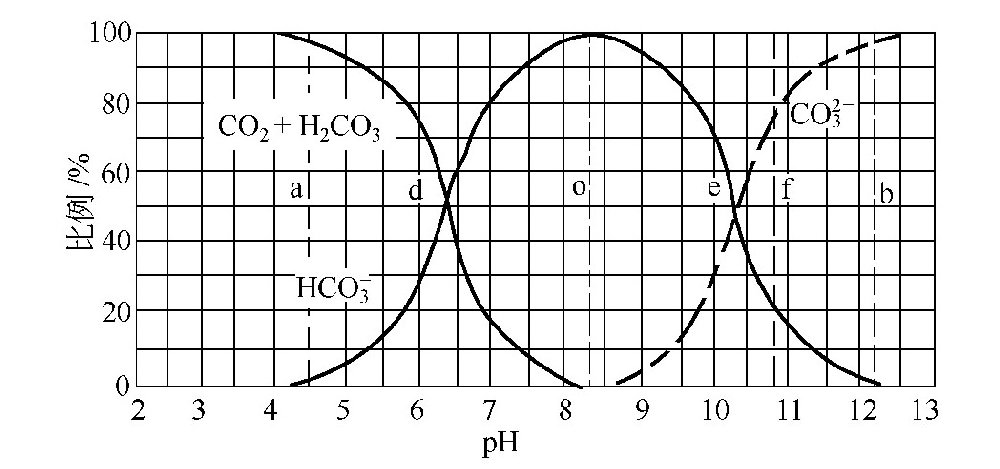
图1-0-6 三种碳酸的比例变化曲线
由图1-0-6可见:在低рН值时,只有CO2+H2CO3;在高pH值时,只有CO2-3;当pH值在8.3左右时,HCO-3占绝对优势。因此,水中碳酸的平衡与pH值有着密切的关系。在一定的pH值条件下,三类碳酸将处于一定的平衡关系。不同pH值下的碳酸平衡系数详表如下。
不同pH值下的碳酸平衡系数(25℃)[1]详表
续表

①α0,[H2CO3]在总碳酸盐中所占的摩尔比。
②α1,[HCO-3]在总碳酸盐中所占的摩尔比。
③α2,[CO2-3]在总碳酸盐中所占的摩尔比。
④![]() ,代表碳酸盐的pH值系数。
,代表碳酸盐的pH值系数。
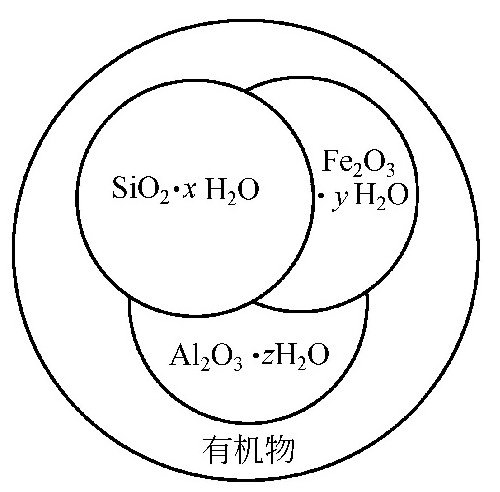
图1-0-7 胶体硅与非反应性硅的结构