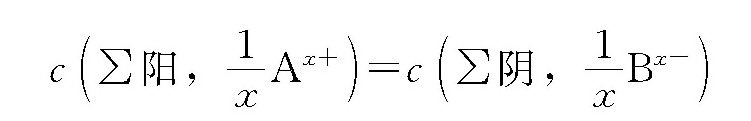电解质是在水溶液中能够导电的物质,非电解质则没有这种能力。所有酸、碱、盐类都是电解质;许多有机物质,如醇、醛、酮等则是非电解质。电解质在水中具有导电能力的原因是由于它在水中发生离解或电离,生成带正电荷的阳离子和带负电荷的阴离子。在溶液中完全电离,全部以离子状态存在的电解质称为强电解质,如强酸、强碱及强酸强碱所形成的盐类。只有一部分电离为离子的电解质称为弱电解质,如弱酸、弱碱及弱酸弱碱所形成的盐类。
弱电解质在水中的电离过程是一种可逆过程。已经电离的正负离子又会相互碰撞,可能再结合成分子,因而分子和离子同时存在,最终在分子和离子之间建立起动平衡状态,称为电离平衡。例如:

其电离通式可写成:

电离平衡式为
K称为电离常数。[A+]、[B-]及[AB]的单位均为物质的量浓度,mol/L。在温度一定时,电离常数为固定值。如25℃时,NH4OH的电离常数K为:
多元酸、碱及盐类可以连续进行数次电离,称为多元电解质的分级电离。例如碳酸可以二级电离,磷酸可以三级电离,放出氢离子。各级电离都可列出电离平衡式,并各有电离常数。碳酸的二级电离平衡式如下:

磷酸的三级电离平衡式为:

在分级电离中,一级电离常数要比二级电离常数高几个数量级,二级电离常数又要比三级电离常数高几个数量级。
了解电离平衡可以了解弱电解质在水中的平衡状况。天然水中存在碳酸,循环冷却水中常使用磷酸盐药剂,它们在水中的平衡状况均会影响系统的腐蚀或结垢状况。
不同温度下的碳酸电离常数[1]如下:

注:pK1=-lgK1,pK2=-lgK2。